- PROCESO DE ELABORACIÓN
- METODOLOGÍA
- PROCESO DE CONSULTA PÚBLICA
¿QUÉ SON LOS INFORMES DE EVALUACIÓN DE TECNOLOGÍAS SANITARIAS?
Los informes de evaluación de tecnologías sanitarias (ETESA o ETS) son materiales de fácil lectura, fuerte impronta visual y alto rigor científico que sintetizan de manera oportuna la evidencia científica para la toma de decisiones sobre coberturas de medicamentos, dispositivos, test diagnósticos y procedimientos terapéuticos, propiciando el uso más eficiente de los recursos e incluyendo la perspectiva de todos los actores involucrados.

¿CÓMO ES EL PROCESO DE CONSULTA PÚBLICA?
Los informes de evaluación de tecnologías sanitarias (ETESA o ETS) siguen un proceso que comienza cuando, frente a un conflicto de cobertura, una institución nos solicita una ayuda técnica que le permita tomar una decisión basada en evidencia científica. La dinámica de elaboración se grafica en el siguiente diagrama y consta de las fases que se amplían a su continuación:
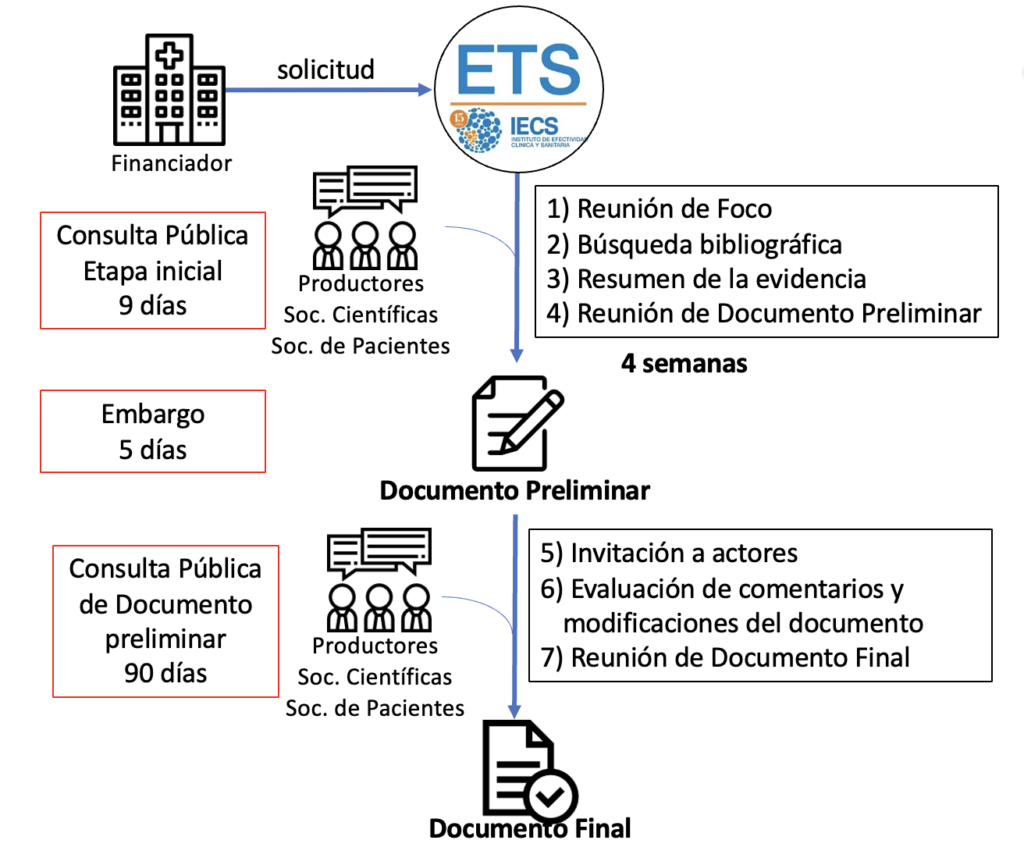
1) Solicitud de los informes de Evaluación de Tecnologías Sanitarias (ETESA): Cualquier institución del Consorcio puede solicitar al IECS la elaboración de un informe de ETESA.
2) Definición del enfoque del documento: Se efectúa una revisión preliminar de la tecnología, se determina la pregunta de investigación o pregunta PICO (por el acrónimo en inglés de Pacientes, Intervención, Comparador y Desenlace) y se elabora la estrategia de búsqueda bibliográfica. Se identifican actores relevantes asociados a la tecnología y se los invita a una primera instancia de consulta pública durante 9 días.
3) Elaboración del documento preliminar:
• Dos investigadores (uno principal y otro tutor), en colaboración con documentalistas de IECS y otros investigadores de la institución o expertos en el tema, seleccionan la mejor evidencia disponible y redactan el documento preliminar según la metodología establecida.
• Se expone y discute el documento preliminar con el equipo de 20 expertos en ETESA del IECS que puede sugerir cambios.
Se comparte el documento con los actores relevantes en una segunda instancia de la consulta pública, denominada “período de embargo” (por 5 días). También se revisa el estilo del documento y se traduce un resumen al inglés.
4) Publicación del documento preliminar:
• Los documentos que realizamos, que se denominan «informes de respuesta rápida” se realizan en un plazo de seis a ocho semanas.
• El solicitante, los actores invitados y los miembros del Consorcio de ETS tienen acceso al documento completo, así como cualquier persona ante requerimiento específico.
• Se invita a los actores relevantes a la tercera instancia de consulta pública, que dura 90 días.
• Los autores y el Equipo de ETESA analizan los comentarios recibidos y realizan eventuales modificaciones.
5) Publicación de la versión final del documento: Se envía la versión final al solicitante y a los actores que participaron de la consulta pública. El documento final se pone a disposición de los miembros del consorcio a través de la base de informes de ETESA de la página web del Consorcio del IECS. Esta base cuenta con más de 1300 informes de evaluación de tecnologías sanitarias.
6) Indización en bases de datos internacionales de ETESA: Los documentos son incorporados en bases de datos internacionales de ETESA como la base mantenida por la Red Internacional de Agencias de ETESA (INAHTA, del inglés International Network of Agencies for Health Technolgy Assessment), y la Base Regional de Informes de Evaluación de Tecnologías en Salud de las Américas (BRISA), de la Organización Panamericana de la Salud (OPS).
¿QUÉ MÉTODOS SE UTILIZAN PARA SU ELABORACIÓN?
La realización de informes de evaluación de tecnologías sanitarias (ETESA o ETS) utiliza métodos de investigación explícitos basados en la evidencia, reproducibles, transparentes y validados orientados a apoyar la toma de decisiones para el uso eficiente de los recursos en la incorporación de nuevas tecnologías al sistema de salud, mediante documentos de fácil lectura e interpretación.
- Definición de la pregunta de investigación (pregunta PICO): La evaluación y selección de los estudios se realiza sobre la base de la pregunta PICO formulada en el foco del documento y que consiste en definir la población y los subgrupos a incluir, la intervención, el o los comparadores y las variables de resultados o desenlaces en orden decreciente de importancia clínica.
- Criterios de búsqueda y bases de datos: Se realiza una búsqueda en las principales bases de datos bibliográficas. Para la búsqueda en PubMed se establece una estrategia de búsqueda específica para cada tecnología. Otros sitios de búsqueda son Tripdatabase, CRD (del inglés Centre for Reviews and Dissemination- University of York), Lilacs, sitios web de financiadores de salud y de sociedades científicas, así como en los buscadores genéricos de internet, en donde se busca con el nombre de la tecnología y sus sinónimos y/o la patología.
- Criterios de inclusión: Se prioriza la inclusión de revisiones sistemáticas, ensayos clínicos controlados aleatorizados, evaluaciones de tecnologías sanitarias, evaluaciones económicas, guías de práctica clínica y políticas de cobertura de diferentes sistemas de salud. No se incluyen estudios no publicados o publicados en formato de resúmenes de congreso. Las políticas de cobertura relevadas en forma sistemática pertenecen a los sistemas de salud públicos de Latinoamérica (Argentina, Brasil, Chile, Uruguay, Colombia y México), Europa (Reino Unido, Alemania y Francia), Australia y Canadá, y a un grupo de aseguradoras estadounidenses públicas y privadas.
- Matriz de valoración de resultados: Las conclusiones del documento se acompañan de una matriz que categoriza los resultados finales en tres dominios, los cuales se presentan en un formato visual de fácil lectura.
- Calidad de la evidencia
- Beneficio neto
- Costo-efectividad e impacto presupuestario
- VER MÁS
La incorporación de tecnologías sanitarias (dispositivos diagnósticos, medicamentos, procedimientos quirúrgicos y dispositivos terapéuticos) afecta a diferentes actores del sistema de salud por lo que es importante instrumentar mecanismos que garanticen su participación efectiva.
Para priorizar qué tecnologías vale la pena incorporar, el IECS realiza informes de tecnologías sanitarias que requieren del esfuerzo coordinado de especialistas (incluyendo epidemiólogos, bibliotecarios y economistas), quienes revisan, analizan y sintetizan la evidencia disponible. Estos documentos además promueven un proceso de consulta pública o instancia abierta de participación de actores relevantes afectados por las tecnologías sanitarias, tales como:
• Sociedades científicas.
• Pacientes y/o cuidadores/as.
• Productores de tecnología.
• Financiadores de salud.
Entérese a través de estos videos:
Proceso de consulta pública para sociedades de pacientes y/o cuidadores/as:
Proceso de consulta pública para sociedades científicas
Proceso de consulta pública para productores de tecnología
Detalle del Proceso de Consulta Pública
Para el proceso de consulta pública cada uno de estos actores puede enviar sus comentarios utilizando formularios electrónicos específicamente diseñados para cada etapa del proceso y para cada actor involucrado. A su vez, estos formularios se encuentran estructurados para facilitar el enfoque de los comentarios a las distintas secciones del documento. A continuación, se muestra un ejemplo de cada uno de ellos.
Formulario de consulta pública para el aporte de información inicial
Formulario de consulta pública científico técnico para documentos preliminares
Formulario de consulta pública para pacientes y público general para documentos preliminares

